اسید سولفوریک چیست؟
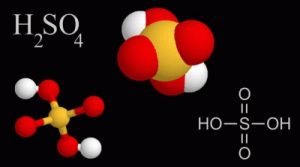
اسید سولفوریک چیست؟ اسید سولفوریک که در گذشته با نام جوهر گوگرد خوانده میشد ، اسیدی بسیار قوی است که با هر درصدی در آب حل میشود و فرمول شیمیایی آن H2SO4 است ، پی اچ (pH) این اسید ۰٫۵ میباشد.
این ماده دارای مولکولهای قطبی است که میتوانند با یکدیگر پیوند هیدروژنی برقرار کنند. پس اسید سولفوریک مایعی است با نقطه جوش بالا و هم چنین یک مایع ویسکوز (دارای گرانروی زیاد) محسوب میشود.
همین شرایط مولکولی باعث میشوند که اسید سولفوریک به خوبی در آب حل شود و محلولهای اسیدی مختلف تولید کند.
اسیدی معدنی و بسیار قوی است که به طور طبیعی در گازهای خارج شده از آتشفشان وجود دارد و با هر درصدی در آب حل میشود. واکنش آن با آب به شدت گرمازا است بههمین دلیل باید از اضافه کردن یکبارهی آب به آن اجتناب کرد.
اسید سولفوریک میل ترکیبی زیادی با آب دارد به طوریکه در واکنش با سایر مواد ، هیدروژن و اکسیژن آنها را به صورت آب جدا میکند. اسید سولفوریک خورنده است و قسمت عمدهای از باران اسیدی را تشکیل میدهد.
قطرات آب به هنگام بارش با آلایندههای کارخانهها و خودروها که در هوا معلق هستند واکنش میدهند و تولید اسید میکنند. اسید سولفوریک با فلزات واکنش میدهد و هر چه دما بالاتر رود میزان این واکنش بیشتر خواهد شد اما بر روی جیوه و سرب تاثیری ندارد.
اسید سولفوریک در لیست مواد خطرناک قرار گرفته است.
ساختار مولکولی و ویژگی اسیدی
این ماده از مولکولهایی شامل یک اتم گوگرد، چهار اتم اکسیژن و دو اتم هیدروژن ساخته شدهاست. از آنجا که هیدروژنها به اتم اکسیژن متصل هستند، حامل بار مثبت جزیی میباشند و قادرند به عنوان هیدروژن اسیدی عمل کنند. با از دست دادن اولین هیدروژن، آنیون هیدروژنسولفات تولید میشود که با توجه به ساختارهای رزونانسی، بسیار پایدار است؛ بنابراین اولین تفکیک سولفوریک اسید، به شکل کامل انجام میشود:
H۲SO۴ + H۲O → HSO۴– + H۳O+
برای دومین مرحله، باید هیدروژن به شکل کاتیون، آنیون هیدروژنسولفات را ترک کند که چندان راحت نیست؛ بنابراین تفکیک دومین هیدروژن اسیدی در سولفوریک اسید، کامل نیست و یک واکنش تعادلی است
HSO۴– + H۲O ⇔ H۳O+ + SO۴۲–
سایر مقالات تخصصی شرکت سلف شیمی را دنبال کنید